运动为何减肥壮骨?终于找到神秘激素鸢尾素的受体
 2020-03-24
2020-03-24

常言道,“生命在于运动。”
因为运动能把我们体内的白色脂肪变成米色脂肪,增加热量消耗,改善高脂饮食引起的代谢紊乱[1];运动还能提高学习能力,缓解阿尔兹海默病,防癌抗癌,甚至延长寿命。
现如今,我们更期待的却是“生命在于不动”。
虽然我们不想运动,但是运动带来的潜在好处,我们却一样都不想落下。好在科学家一直在想办法满足人类这种不合理的需求。
就在上周,哈佛大学医学院Bruce Spiegelman教授团队长达6年的努力,往满足人类上述不合理需求的方向上,迈出了关键的一大步。
他们找到了运动作用于人体组织器官细胞的受体,终于打通了运动有益健康的信号通路。他们的这项重要研究成果刊登在顶级期刊《细胞》上[1]。
与Spiegelman教授团队研究领域相同的生物学家Maria Grano则表示,“如果我们能由此开发出一种药物,给那些不能进行体育锻炼的人用,那就太棒了。”[2]
奇点糕想说的是,如果这能开发出那种药物,我们不想运动的人也想要。

Bruce Spiegelman
要说清楚Spiegelman教授团队研究的重要性,以及价值和意义,我们还得从不太遥远的1998年说起。
那一年,在哈佛大学医学院丹娜·法伯癌症研究院已经任职16年的Spiegelman教授当时正在研究肥胖。他们团队在小鼠的棕色脂肪细胞和骨骼肌细胞中找到了一个叫做PGC-1α的分子,这个分子参与了棕色脂肪产热的调节[3]。
在随后的10年中,Spiegelman团队研究做的不温不火,围绕PGC-1α也做了不少工作。其中,他们发现PGC-1α的表达受运动调节[4],增加肌肉中PGC-1α的表达能减少小鼠年龄增长带来的肥胖和代谢紊乱[5]。这就在运动和健康之间架起了桥梁。
不过,推动我们认知升级的重大事件出现在2009年。
当年4月9日,对全世界的胖子们而言,是极具历史意义的一天。
那天,《新英格兰医学期刊》(NEJM)用3篇临床研究论文[6-8],颠覆了我们对成人体内棕色脂肪的认知。三个研究团队首次证实,成人体内不仅有负责消耗能量产热的棕色脂肪,而且这种棕色脂肪在成人体内也有正常的生理功能。
这三篇研究论文,让全世界研究肥胖的科学家意识到,调动人体的棕色脂肪有可能由于代谢类疾病的治疗,对于肥胖和二型糖尿病而言意义不可谓不重大。
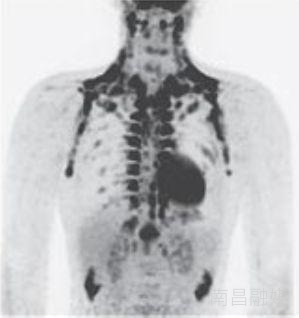
PET CT下的棕色脂肪
Spiegelman团队加快了研究的步伐。之前近30年的研究积累,也让他们近水楼台先得月。
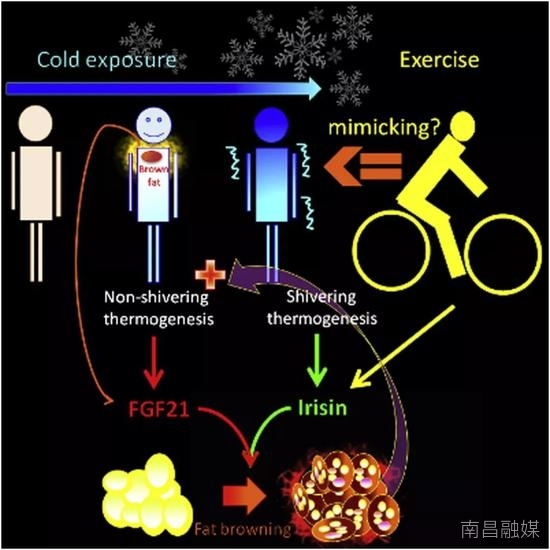
在2012年,Spiegelman团队宣布,运动诱导产生的PGC-1α,会刺激细胞产生一种叫做鸢尾素(irisin)的激素,鸢尾素作用于皮下脂肪,促进白色脂肪转化成米色脂肪[9]。
这个研究打开了研究运动与健康之间关系的大门。
很快,在随后的研究中,科学家发现除了让脂肪米色化外,鸢尾素还被发现有保护神经[10]、增加皮质骨量[11]、减少骨丢失[12]等作用。
不过在什么样的运动能产生鸢尾素上,可以说是众说纷纭,有支持耐力运动的,有说抗阻运动才行的,还有说耐力运动和抗阻运动都能产生鸢尾素的[13]。
但要说产生鸢尾素最有效的运动,恐怕还是寒战了,毕竟鸢尾素的这条信号通路,本来是让人冷的发抖的时候,增加棕色脂肪的产热,保持体温[14]。在寒冷诱导脂肪米色化的过程中,除了交感神经,还有鸢尾素的作用!
既然鸢尾素的作用这么多,是不是打点鸢尾素就能当锻炼了?
遗憾的是,这个想法非常天真,因为鸢尾素在血液中的的半衰期还不到1小时。
Spiegelman的团队明白,找到了鸢尾素,还不是终点,他们需要在细胞的表面找到鸢尾素的受体。一旦找到了这个受体,他们就可以靶向这个受体开发药物。
其实早在2012年发现鸢尾素时,Spiegelman就注意到,鸢尾素在不同的哺乳动物中高度保守,小鼠和人类的鸢尾素100%完全相同。作为对比,胰岛素、胰高血糖素和瘦素,在小鼠和人类间的一致性分别只有85%、90%和83%。
这样的高度一致性,一方面反映了鸢尾素高度保守的重要功能,另一方面也让Spiegelman猜测,它的作用很可能是通过一种细胞表面受体介导的。事实确实如Spiegelman所想。
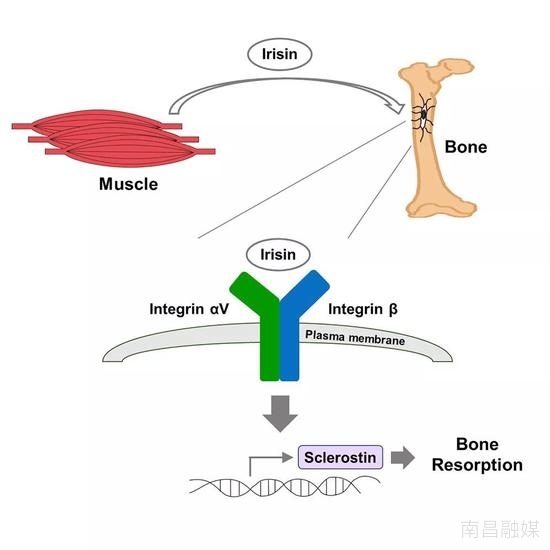
这次试验中,研究人员选用了骨细胞作为实验对象。研究人员使用带标签的鸢尾素“钓”出了骨细胞中能和鸢尾素结合的蛋白,然后通过质谱等分析手段,确定了鸢尾素的受体——整合素αV/β5。
随后使用整合素抑制剂阻断鸢尾素作用的试验也证实了整合素αV/β5就是鸢尾素的受体。而在脂肪细胞上,整合素抑制剂同样能阻止鸢尾素促进脂肪米色化的作用,鸢尾素促进脂肪细胞米色化的作用也是通过整合素实现的!
找到了鸢尾素的受体,Spiegelman计划在下一步优化出不同版本的鸢尾素及其抗体:“这样我们就可以通过蛋白质疗法在体内操纵其效果。我们将研究其对骨骼、脂肪和神经系统的影响。”
参考文献:
[1]Kim H, Wrann C D, Jedrychowski M, et al。 Irisin Mediates Effects on Bone and Fat via αV Integrin Receptors[J]。 Cell, 2018, 175(7): 1756-1768。 e17。
[2]https://www.the-scientist.com/news-opinion/researchers-identify-irisins-receptor-in-bone-and-fat-65208
[3]Puigserver P, Wu Z, Park C W, et al。 A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J]。 Cell, 1998, 92(6): 829-839。
[4]Handschin C, Spiegelman B M。 The role of exercise and PGC1α in inflammation and chronic disease[J]。 Nature, 2008, 454(7203): 463。
[5]Wenz T, Rossi S G, Rotundo R L, et al。 Increased muscle PGC-1α expression protects from sarcopenia and metabolic disease during aging[J]。 Proceedings of the National Academy of Sciences, 2009: pnas。 0911570106。
[6]Cypess A M, Lehman S, Williams G, et al。 Identification and importance of brown adipose tissue in adult humans。[J]。 The New England Journal of Medicine, 2009, 360(15): 1509-1517。
[7]Lichtenbelt W D, Vanhommerig J W, Smulders N M, et al。 Cold-Activated Brown Adipose Tissue in Healthy Men[J]。 The New England Journal of Medicine, 2009, 360(15): 1500-1508。
[8]。Virtanen K A, Lidell M E, Orava J, et al。 Functional brown adipose tissue in healthy adults。[J]。 The New England Journal of Medicine, 2009, 360(15): 1518-1525。
[9]Boström P, Wu J, Jedrychowski M P, et al。 A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]。 Nature, 2012, 481(7382): 463。
[10]Wrann C D, White J P, Salogiannnis J, et al。 Exercise induces hippocampal BDNF through a PGC-1α/FNDC5 pathway[J]。 Cell metabolism, 2013, 18(5): 649-659。
[11]Colaianni G, Cuscito C, Mongelli T, et al。 The myokine irisin increases cortical bone mass[J]。 Proceedings of the National Academy of Sciences, 2015, 112(39): 12157-12162。
[12]Colaianni G, Mongelli T, Cuscito C, et al。 Irisin prevents and restores bone loss and muscle atrophy in hind-limb suspended mice[J]。 Scientific reports, 2017, 7(1): 2811。
[13]Buscemi S, Corleo D, Buscemi C, et al。 Does iris (in) bring bad news or good news?[J]。 Eating and Weight Disorders-Studies on Anorexia, Bulimia and Obesity, 2018, 23(4): 431-442。
[14]Lee P, Linderman J D, Smith S, et al。 Irisin and FGF21 are cold-induced endocrine activators of brown fat function in humans[J]。 Cell metabolism, 2014, 19(2): 302-309。
本文作者 | 孔劭凡 &BioTalker
睡不醒的冬三月





